Magensäureblocker (kurz Säureblocker) lindern Sodbrennen und ermöglichen das Abheilen einer geschädigten Magenschleimhaut. Allerdings können sie auch die Aufnahme wichtiger Mikronährstoffe im Körper stören und zu Folgeerkrankungen wie Blutmangel und Osteoporose führen. Erfahren Sie, welche Mikronährstoffe wichtig sind und wie man einem Mangel am besten vorbeugen und ihn behandeln kann.
Säureblocker: Wirkung, Anwendung und Nebenwirkungen
Wie wirken Säureblocker?
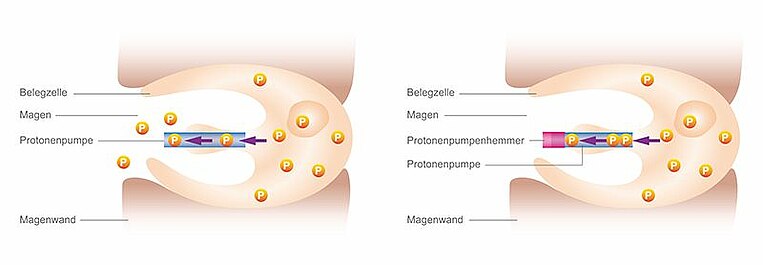
Säureblocker hemmen die Bildung von Magensäure, indem sie die Magensäureproduktion in bestimmten Magenzellen blockieren. Dadurch schützen diese Medikamente die Schleimhaut im Magen vor einem Säureangriff, wenn zu viel Säure gebildet wird oder der Magen geschädigt ist.
Info
Spezielle Zellen der Magenschleimhaut (Belegzellen) erzeugen die Säure (Protonen) und pumpen sie in den Magenraum. Säureblocker blockieren diese Pumpe. Sie werden daher auch Protonenpumpenhemmer oder Protonenpumpeninhibitoren (PPI) genannt.
Zu den Säureblockern zählen die Medikamentenwirkstoffe Omeprazol (wie Antra MUPS®), Esomeprazol (wie Nexium®), Pantoprazol (wie Rifun® und Pantozol®), Lansoprazol (wie Agopton®), Dexlansoprazol (wie Dexilant®) und Rabeprazol (wie Pariet®). Auf dem Markt sind Tabletten, Kapseln und Infusionslösungen verfügbar. Säureblocker sind sowohl auf Rezept als auch ohne ärztliche Verordnung erhältlich.
Einsatzgebiete von Säureblockern
Säureblocker werden immer dann eingesetzt, wenn die Magensäure die Schleimhaut in Speiseröhre, Magen oder Darm reizt, zum Beispiel bei
- Sodbrennen
- Magen- und Darmgeschwüren
- Schmerzmedikamenten wie nicht steroidalen Entzündungshemmern (Magenschutz)
- Verdauungsstörungen im Oberbauch (Dyspepsie)
- Ergänzung einer antibiotischen Therapie bei Helicobacter pylori. Das Bakterium ist eine häufige Ursache für Magenschleimhautentzündungen (Gastritis).
Nebenwirkungen: Mikronährstoffmangel durch Säureblocker möglich
Beobachtungsstudien lassen annehmen, dass die langfristige Einnahme von Säureblockern zu einem Mangel an folgenden Vitaminen, Mineralstoffen und Spurenelementen führt:
Durch die gezielte Einnahme dieser Stoffe im Rahmen der Mikronährstoffmedizin beugt man einer Unterversorgung und damit einhergehenden Mangelsymptomen vor. Beispielsweise kann ein Mangel an Vitamin B12 und Eisen eine Blutarmut (Anämie) verursachen oder ein Calciummangel Osteoporose.
Zudem lösen Säureblocker mitunter weitere Nebenwirkungen aus wie Kopfschmerzen, Bauchschmerzen, Verstopfung oder Durchfall. Auch eine veränderte Darmflora ist möglich: Durch die geringe Säure im Magen kann es langfristig zu einer bakteriellen Fehlbesiedelung im Dünndarm kommen oder zu Magen-Darm-Infektionen. Die Säure im Magen tötet normalerweise krankmachende Keime ab.
Nebenwirkungen vermeiden
Eine Unterversorgung mit Vitamin B12 ausgleichen
Hintergrund und Wirkweise
Säureblocker behindern die Aufnahme von Vitamin B12: Das Vitamin ist in Lebensmitteln an Eiweiße gebunden. Damit der Körper es aufnehmen kann, muss es zunächst von Eiweißen abgespalten werden. Dazu ist die Magensäure notwendig, die aber durch Säureblocker für etwa 24 Stunden gehemmt wird. Zusätzlich können Magenerkrankungen dazu führen, dass Vitamin B12 nur sehr schlecht aufgenommen wird.
Mehrere Untersuchungen legen nahe, dass Säureblocker einen Vitamin-B12-Mangel verursachen: Eine große Beobachtungsstudie zeigte, dass Patienten mit einem Vitamin-B12-Mangel häufiger Säureblocker einnahmen als Patienten, bei denen kein Mangel auftrat. Die Gefahr für eine Unterversorgung mit Vitamin B12 stieg mit der Anwendungsdauer und der Anzahl der täglich eingenommen Säureblocker-Tabletten: Bei mehr als zweijähriger Einnahme der Säureblocker erhöhte sich das Risiko für einen Mangel um das Anderthalbfache. Bei Patienten, die mehr als eineinhalb Tabletten pro Tag einnahmen, verdoppelte es sich sogar.
Ein Vitamin-B12-Mangel äußert sich durch Blutarmut (Anämie). Diese tritt vor allem bei älteren Menschen auf. Der Mangel kann sich daneben durch Müdigkeit, erhöhte Infektionsanfälligkeit sowie Nerven- und Gedächtnisstörungen bemerkbar machen. Auch verursacht er hohe Homocysteinwerte. Homocystein gilt in hohen Mengen als Zellgift, das mit verschiedenen Krankheiten in Verbindung gebracht wird, wie Herz-Kreislauf-Erkrankungen oder Osteoporose.
Dosierung und Einnahmeempfehlung für Vitamin B12
Damit sich kein Vitamin-B12-Mangel entwickelt, kann bei regelmäßiger Einnahme von Säureblockern täglich zwischen 50 und 250 Mikrogramm Vitamin B12 eingenommen werden. Ein besonders hohes Risiko für einen Vitamin-B12-Mangel haben Menschen mit chronischen Magenerkrankungen und vermutlich auch Personen, die für mindestens zwei Jahre Säureblocker einnehmen. Neben Älteren ab 60 Jahren sind zudem gefährdet: Vegetarier und Veganer, schlecht ernährte Personen sowie Patienten, die das Diabetesmedikament Metformin (wie Diabesin®, Siofor®) einnehmen.
Wenn sich bereits eine Anämie entwickelt hat, empfehlen Mikronährstoff-Experten, unter ärztlicher Kontrolle deutlich mehr Vitamin B12 (mindestens 1.000 Mikrogramm) einzunehmen.
Tipp
Sinnvolle Kombination: Die Ergänzung von Vitamin B12 empfiehlt sich zusammen mit Folsäure und Vitamin B6. Alle drei B-Vitamine sind am Abbau von Homocystein beteiligt.
Wenn sich bereits eine Anämie entwickelt hat, empfehlen Mikronährstoffmediziner deutlich mehr Vitamin B12 (mindestens 1.000 Mikrogramm).
Vitamin B12 und Homocystein im Labor bestimmen lassen
Bei längerer Einnahme von Säureblockern sollte mindestens einmal im Jahr der Vitamin-B12-Spiegel im Blut bestimmt werden. Einerseits kann man so einen Mangel frühzeitig erkennen. Andererseits lässt sich so auch eine Überversorgung verhindern – vor allem, wenn Vitamin B12 lange in höheren Dosierungen eingenommen wird.
Zur Bestimmung der Blutwerte eignet sich am besten die Messung von Holotranscobalamin (HoloTC), da dieser Wert am aussagekräftigsten ist. Liegt er im Serum unter 50 Pikomol pro Liter, besteht ein Mangel. Daneben kann man Vitamin B12 direkt bestimmen. Hier sollte der Wert im Serum zwischen 300 und 900 Pikogramm pro Millimeter liegen.
Auch liefern die Homocysteinwerte einen Hinweis auf die Versorgung mit Vitamin B12. Für sie gilt: je geringer, desto besser. Normwerte liegen zwischen 5 bis 9 Mikromol pro Liter.
Vitamin B12: zu beachten in der Schwangerschaft und Stillzeit sowie bei Erkrankungen
In der Schwangerschaft und Stillzeit sollten Vitamin-B12-Dosen über dem täglichen Bedarf von 5 Mikrogramm nur bei einem Mangel und nach Absprache mit dem Frauenarzt eingenommen werden.
Personen mit Nierenerkrankungen sollten die Einnahme von Vitamin B12 mit dem Arzt besprechen. Zudem sollten sie es in Form von Methylcobalamin einnehmen, nicht aber als Cyanocobalamin. Es gibt Hinweise, dass Cyanocobalamin in hohen Dosen für Nierenpatienten schädlich ist.
Bei Krebs und hohem Krebsrisiko (Raucher) könnte dauerhaft hoch dosiertes Vitamin B12 das Fortschreiten oder die Entwicklung fördern. Dann sollte die Ergänzung von über 55 Mikrogramm mit dem Arzt abgesprochen sein.
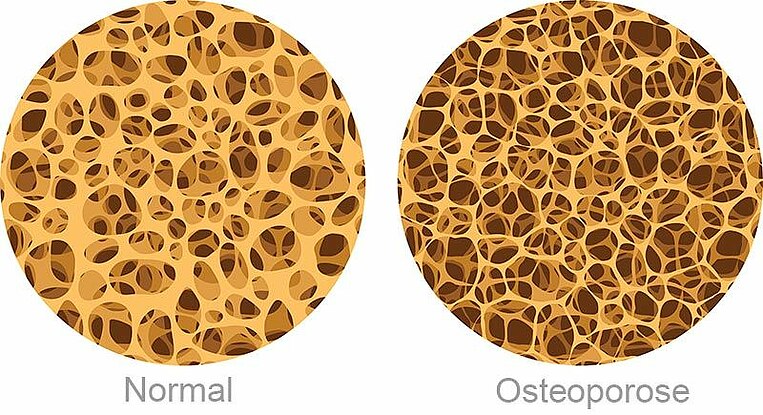
Säureblocker stören den Calciumstoffwechsel und erhöhen das Risiko für Knochenbrüche
Hintergrund und Wirkweise
Übersichtsarbeiten zeigen, dass eine dauerhafte Anwendung von Säureblockern zu einer Störung des Calciumhaushalts und zu Knochenschwund (Osteoporose) führt: Für die Aufnahme von Calcium aus der Nahrung ist Magensäure erforderlich. Dies gilt insbesondere für schwer lösliche Calciumsalze wie Calciumcarbonat. Es ist die häufigste Calciumverbindung in Lebensmitteln. Durch den Säureblocker-bedingten Mangel an Magensäure wird weniger Calcium aus diesen Salzen gelöst und aufgenommen. Herrscht ein Calciummangel im Blut, löst der Körper Calcium aus den Knochen. Das Risiko für Knochenbrüche steigt.
Auch wenn die zugrunde liegenden Mechanismen bisher nicht vollständig geklärt sind, zeigen alle aktuellen Übersichtsarbeiten, dass eine langfristige Einnahme von Säureblockern das Risiko für Knochenbrüche erhöht. Die Lebensmittelüberwachungs- und Arzneimittelbehörde der USA (FDA) warnt bereits vor einem möglichen Knochenbruchrisiko durch Säureblocker, wenn sie in einer hohen Dosierung und/oder länger als ein Jahr eingenommen werden. Eine vorsorgliche Einnahme von Calcium könnte dem vorbeugen.
Info
Calcium dürfte nebenbei auch den Vitamin-B12-Spiegel verbessern: In einer vorläufigen Studie fanden Forscher heraus, dass die Einnahme von Calcium den Vitamin-B12-Spiegel steigert. Anwender von Säureblockern, die zusätzlich Calcium einnahmen, litten seltener an einem Vitamin-B12-Mangel als Personen, die kein Calcium ergänzten.
Dosierung und Einnahmeempfehlung für Calcium
Begleitend zur langfristigen Einnahme von Säureblockern werden in der Mikronährstoffmedizin 250 bis 500 Milligramm Calcium pro Tag empfohlen. Besteht ein besonders hohes Risiko für einen Mangel – zum Beispiel bei Veganern oder Senioren – können in Rücksprache mit dem Experten auch bis zu 1.000 Milligramm sinnvoll sein. Bei höheren Dosierungen sollte die Gesamtmenge über den Tag verteilt werden, um eine hohe Aufnahme im Darm zu gewährleisten. Sinnvoll sind zum Beispiel zweimal täglich 500 Milligramm.
Bei Einnahme von Säureblockern ist ein Präparat mit gut verfügbarem Calcium, wie Calciumcitrat, besonders wichtig: Untersuchungen zeigen, dass diese Calciumverbindung unabhängig von der Säure im Magen aufgenommen werden kann.
Werden noch andere Mittel gegen Sodbrennen genommen (Antazida), ist Vorsicht geboten: Antazida enthalten ebenfalls Calciumverbindungen wie Calciumcarbonat. Dann sollte nicht zusätzlich Calcium eingenommen werden.
Tipp
Um Osteoporose vorzubeugen, empfiehlt es sich, die Einnahme von Calcium mit den knochenwirksamen Mikronährstoffen Vitamin D und Vitamin K2 zu kombinieren: Vitamin D verbessert die Calciumaufnahme über den Darm und Vitamin K2 fördert die Einlagerung von Calcium in die Knochen. Vitamin K2 verhindert dabei, dass Calcium an den falschen Orten, wie den Arterien, eingelagert wird und Arteriosklerose auslöst.
Calcium: zu beachten bei Erkrankungen und Medikamenteneinnahme
Calcium darf bei zu hohen Calciumwerten nicht eingenommen werden. Das kommt zum Beispiel vor bei einer Überfunktion der Nebenschilddrüse (Nebenschilddrüsentumoren), Sarkoidose, Knochenmetastasen und Knochenmarkkrebs (Multiples Myelom). Bei Pankreatitis und Nierenschwäche sollte ein Arzt festlegen, ob und wie viel Calcium genommen werden kann. Kranke Nieren und Dialyse führen zu einem gestörten Mineralstoffhaushalt.
Säureblocker können das Risiko für Nierensteine erhöhen. Betroffene müssen mit Calcium aufpassen: Es kann die Bildung der Steine begünstigen. Daher sollte vor der Einnahme ein Arzt gefragt werden. Er kann die Calciumausscheidung messen sowie die Vorteile und Nachteile der Einnahme abwägen.
Wenn Calciumpräparate gleichzeitig mit anderen Medikamenten eingenommen werden, kann die Aufnahme dieser Medikamente vermindert werden. Dazu gehören einige Antibiotika (wie Tetracyclin®, Doxycylin®), Schilddrüsenhormone mit L-Thyroxin (wie Berlthyrox®, Eferox ®) und bestimmte Osteoporose-Wirkstoffe aus der Klasse der Bisphosphonate (wie Fosamax®, Skelid®).
Blutdruck- sowie Entwässerungsmittel aus der Klasse der Thiaziddiuretika (wie Disalunil®, Esidrix®) und das Psychopharmakon Lithium hemmen die Ausscheidung von Calcium durch die Nieren. Wird dann Calcium eingenommen, können die Calciumwerte zu stark ansteigen. Besprechen Sie die Einnahme daher mit Ihrem Arzt.
Säureblocker verursachen einen Magnesiummangel
Hintergrund und Wirkweise
Experten vermuten, dass durch Säureblocker weniger Magnesium aus der Nahrung im Darm aufgenommen wird. In einer Auswertung fassten Forscher die verfügbaren Daten zusammen: Die langfristige Einnahme von Säureblockern könnte nach durchschnittlich fünf Jahren zu einem Magnesiummangel führen. Nach dem Absetzen der Säureblocker normalisierte sich der Magnesiumspiegel innerhalb kürzester Zeit wieder. Nahmen die Teilnehmer jedoch erneut Säureblocker ein, kam es wieder zu einem Magnesiummangel. Eine kurzzeitige Anwendung von Säureblockern (ein bis drei Tage) scheint hingegen keine Auswirkungen zu haben.
Infolge eines Magnesiummangels kann es zu Muskelproblemen kommen, wie Krämpfen, Verspannungen und Zittern. Auch Konzentrationsstörungen, Depressionen, Schlaflosigkeit und Kopfschmerzen treten auf. Ein langjähriger Mangel kann zu Herzrhythmusstörungen und Herzversagen führen.
Expertenwissen
Es werden viele Mechanismen diskutiert, die für die schlechtere Magnesiumversorgung durch Protonenpumpenhemmer verantwortlich sind. Sie betreffen zum Beispiel die Magnesiumtransporter:
Bei der aktiven Aufnahme wird Magnesium im Dünndarm durch spezielle Transporter aufgenommen, die durch Protonenpumpenhemmer gehemmt werden. Der Körper kann dann aber kompensatorische Mechanismen nutzen. Zum Beispiel kann Magnesium über eine passive Aufnahme ins But gelangen: Liegen im Darm größere Mengen Magnesium vor, wandert es durch Ionenkanäle durch die Darmwand. Laboruntersuchungen weisen allerdings darauf hin, dass das Medikament Omeprazol aber auch die passive Aufnahme von Magnesium hemmt.
Dosierung und Einnahmeempfehlung für Magnesium
Mikronährstoff-Experten empfehlen begleitend zur Einnahme von Säureblockern 100 bis 300 Milligramm Magnesium am Tag. Dazu eignen sich vor allem gut bioverfügbare, organische Verbindungen wie Magnesiumcitrat. Ab einer regelmäßigen Dosierung über 250 Milligramm Magnesium pro Tag empfiehlt es sich, die Werte im Blut zu kontrollieren.
Um einem Mangel vorzubeugen, reicht es manchmal nicht, Magnesium einzunehmen. Bessern sich die Blutwerte nicht, sollten die Säureblocker zeitweise abgesetzt werden. Das Risiko besteht vor allem für Menschen mit schweren Verdauungsstörungen oder Nierenerkrankungen. Ein erhöhtes Risiko gilt auch für Medikamente, die den Magnesiumspiegel senken – wie Entwässerungsmittel aus der Gruppe der Thiaziddiuretika (zum Beispiel Hydrochlorothiazid wie Esidrix®) oder der Wirkstoff Digoxin (wie Digimed®) gegen Herzschwäche.
Expertenwissen
H2-Blocker sind eine Alternative zu Säureblockern (Protonenpumpenhemmern). Sie blockieren die Wirkung von Histamin, was im Magen die Bildung von Magensäure hemmt. Die Magnesiumaufnahme ist mit H2-Blockern besser, aber diese Medikamente führen mitunter zu einem Vitamin-B12-Mangel.
Magnesium im Vollblut bestimmen
Im Körper kommt Magnesium hauptsächlich in den Zellen vor. So enthalten rote Blutzellen etwa dreimal so viel Magnesium wie die Blutflüssigkeit (Blutserum). Deshalb sollte Magnesium vom Arzt am besten im Vollblut gemessen werden. Dieses enthält alle Blutzellen. Eine Magnesiumbestimmung im Vollblut ist daher aussagekräftiger als im Serum.
Normalwerte liegen zwischen 1,38 bis 1,50 Millimol pro Liter. Mikronährstoff-Experten empfehlen Patienten, ihre Magnesiumwerte ein bis zweimal im Jahr überprüfen zu lassen.
Magnesium: zu beachten bei Nierenerkrankungen und Medikamenteneinnahme
Patienten mit chronischen Nierenerkrankungen sollten Magnesium nicht einnehmen. Geschädigte Nieren können es nicht gut ausscheiden. Überschüssiges Magnesium könnte sich im Blut anreichern.
Bei der gleichzeitigen Einnahme von Magnesium und bestimmten Arzneimitteln ist Vorsicht geboten. Magnesium könnte die Wirkung herabsetzen. Es sollte daher mit einem Abstand von mindestens zwei Stunden eingenommen werden. Dazu zählen:
- bestimmte Antibiotika wie Ciprofloxacin (wie Ciloxan®), Enoxacin (wie Enoxor®), Levofloxacin (wie Tavanic®) und Doxycyclin (wie Supracyclin®)
- Osteoporose-Wirkstoffe der Klasse der Bisphosphonate wie Alendronat (wie Fosamax®, Tevanate®), Clodronat (wie Bonefos®) oder Etidronat (wie Didronel®)
- Chelatbildner wie Penicillamin (Metalcaptase®)
Geringere Eisenaufnahme durch Säureblocker
Hintergrund und Wirkweise
Die Magensäure hilft dabei, Eisen aus den schwer löslichen Eisenverbindungen freizusetzen und in die Form umzuwandeln, die der Körper aufnehmen kann. Vor allem die Eisenaufnahme aus Pflanzen hängt von der Magensäure ab. Verschiedene Studien lassen vermuten, dass Säureblocker zu einem Eisenmangel führen könnten.
Eine große Beobachtungsstudie mit insgesamt 466.360 Teilnehmern sowie eine Studienübersicht zeigen zum Beispiel, dass Patienten, die Säureblocker über Jahre einnahmen, ein erhöhtes Risiko für einen Eisenmangel hatten: Personen, welche diese Medikamente für mindestens zehn Jahre und über eineinhalb Pillen täglich zu sich nahmen, hatten ein vierfach erhöhtes Risiko für einen Eisenmangel.
Die Datenlage ist allerdings nicht eindeutig. Einzelne Studien sprechen auch dagegen. Der Eisenmangel scheint vor allem die Personen zu betreffen, die bereits schlechte Eisenwerte haben. Mikronährstoff-Experten raten, bei langfristiger Anwendung von Säureblockern den Eisenstatus ein- bis zweimal jährlich überprüfen zu lassen, um einen Mangel frühzeitig zu erkennen.
Ein Eisenmangel kann der Grund für Müdigkeit, Lern- und Konzentrationsschwächen, blasse Haut oder Blutarmut sein. Gefährdet sind vor allem Vegetarier und Veganer.
Dosierung und Einnahmeempfehlung für Eisen
Vor einer Einnahme sollte der Eisenstatus im Blut gemessen werden. Liegt ein Mangel vor, kann der Verzehr von eisenreichen Lebensmitteln ihn meist nicht ausgleichen. Der Arzt empfiehlt dann ein Eisenpräparat. Die Dosis richtet sich nach dem Grad des Mangels: Besteht ein starker Eisenmangel sind pro Tag zwischen 50 und 100 Milligramm notwendig. Bei einem leichten Mangel können 20 bis 40 Milligramm ausreichend sein. Die Eiseneinnahme muss so lange fortgeführt werden, bis sich die Laborwerte wieder normalisiert haben.
Eisen nimmt man am besten auf leeren Magen ein. Hat man allerdings einen empfindlichen Magen, verbessert die Einnahme zum Essen die Verträglichkeit. Außerdem sollte Eisen zeitversetzt zu Magnesium und Calcium ergänzt werden, denn die Mineralstoffe hemmen sich in ihrer Aufnahme. Werden gegen zu viel Magensäure auch H2-Blocker eingesetzt, muss ein Abstand von mindestens zwei Stunden zum Eisenpräparat eingehalten werden.
Bessern sich die Werte nicht, sollte der Säureblocker für einige Zeit abgesetzt werden. Auch kann Eisen bei einem schweren Mangel direkt in die Venen gegeben werden (Eiseninfusion).
Tipp
Lassen sich die Eisenwerte nicht anheben, sollte der Arzt außerdem testen, ob eine Helicobacter-pylori-Infektion vorliegt. Durch die Infektion entstehen im Magen kleinste Blutungen, die dafür sorgen, dass Eisen verloren geht. Vitamin C sorgt daneben für eine besser Eisenaufnahme im Darm.
Verschiedene Laborwerte zur Eisenbestimmung notwendig
Der Arzt erhebt bei einem Mangel mehrere Eisen-Laborwerte. Er bestimmt in der Regel den eisenhaltigen Blutfarbstoff Hämoglobin und das Eisen-Transporteiweiß Ferritin. Die Hämoglobinwerte sollten bei Frauen über 12 Gramm pro Deziliter und bei Männern über 15 Gramm pro Deziliter betragen. Ferritin beträgt bei Männern normalerweise zwischen 34 bis 310 Mikrogramm pro Liter und bei Frauen zwischen 23 bis 110 Mikrogramm pro Liter.
Eisen: zu beachten bei Erkrankungen und Medikamenteneinnahme
Bei einer schweren Erkrankung der Leber oder Niere sollte die Einnahme von Eisen mit dem Arzt besprochen werden. Gleiches gilt bei Durchfall, Entzündungen oder Geschwüren im Magen oder Darm sowie bei schweren Lungenerkrankungen.
Bei einer Eisenspeicherkrankheit (Hämochromatose) darf man kein Eisen einnehmen. Es kommt sonst zu einer Eisenüberladung. Das kann auch bei bestimmten Anämie-Formen passieren, die mit vielen Bluttransfusionen behandelt werden (Mittelmeeranämie).
Bei Nervenkrankheiten haben Wissenschaftler erhöhte Eisenablagerungen im Gehirn festgestellt. Sprechen Sie vor einer Einnahme zur Sicherheit mit dem Arzt. Das gilt bei Alzheimer, Parkinson, Chorea Huntington oder amyotropher Lateralsklerose (ALS).
Die Aufnahme und die Wirkung einer Reihe von Medikamenten werden durch Eisen vermindert. Halten Sie deshalb einen Einnahmeabstand von zwei bis drei Stunden ein. Dazu gehören:
- Blutdrucksenker: zum Beispiel ACE-Hemmer mit Wirkstoffen wie Benazepril (Lotensin HCT®) oder Captopril (Tensobon®)
- Osteoporosemedikamente: zum Beispiel Bisphosphonate mit Wirkstoffen wie Alendronat (Fosamax®) oder Pamidronat (Aredia®)
- Parkinsonmedikamente: zum Beispiel Decarboxylasehemmer mit dem Wirkstoff Carbidopa (Duodopa®) oder L-Dopa (Levopar®)
- Schilddrüsenmedikamente: Thyroxin (L-Thyroxin®)
- Antibiotika: zum Beispiel Penicillin (etwa Ampicillin wie Unacid®), Tetracycline (etwa Minocyclin wie Skid®) oder Chinolon-Antibiotika (etwa Ciprofloxazin wie Ciprofloxacin-ratiopharm® oder Norfloxazin wie Norfluxx® und Barazan®); Rifampicin (wie Eremfat® oder Rifa®)
- Rheumamittel/Schwermetall-Binder: Penicillamin (Metalcaptase®)
Gichtmedikamente mit dem Wirkstoff Allopurinol (Zyloric®, Allobeta®) können die Speicherung von Eisen in der Leber erhöhen. Das kann den Körper schädigen. Eisenpräparate sollten daher nicht während einer Behandlung mit diesem Wirkstoff eingenommen werden.
Vitamin-C-Haushalt ist durch Säureblocker gestört
Hintergrund und Wirkweise
Auch die Vitamin-C-Versorgung kann durch die Einnahme von Säureblockern negativ beeinflusst werden: Vitamin C ist bei einem geringen Säuregehalt (neutraler oder hoher pH-Wert) instabil. Dadurch nimmt vermutlich die Menge der antioxidativ wirksamen Form des Vitamins – der Ascorbinsäure – im Magen und Blut ab.
Blutwerte: Eine erste Studie mit 29 gesunden Menschen belegt, dass der Vitamin-C-Spiegel im Blut um mehr als zwölf Prozent abnahm, nachdem die Probanden 40 Milligramm des Säureblockers Omeprazol für vier Wochen eingenommen hatten. Das spricht dafür, dass Vitamin C aus Lebensmitteln während der Anwendung von Säureblockern für den Körper weniger verfügbar ist.
Konzentration im Magen: In einer Vorstudie sank unter Omeprazol-Behandlung (40 Milligramm für vier Wochen) der Vitamin-C-Gehalt im Magensaft deutlich.
Info
Eine Folge von zu wenig Vitamin C im Magen könnte sein, dass die Belastung mit Nitrit-haltigen Lebensmitteln ansteigt. Dieser Stoff bildet krebserregende Nitrosamine. Sie werden mit einem hohen Magenkrebsrisiko in Verbindung gebracht. Vitamin C verhindert dagegen die Bildung dieser krebserregenden Stoffe.
Patienten mit Infektionen durch das Magenbakterium Helicobacter pylori scheinen besonders von einer Störung des Vitamin-C-Stoffwechsels durch Säureblocker betroffen zu sein. Diese Bakterien lösen eine Magenschleimhautentzündung aus, die zu einer chronischen Entleerung der Vitamin-C-Speicher führt.
Ein Vitamin-C-Mangel zeichnet sich anfangs durch Antriebslosigkeit, Müdigkeit und Erschöpfung aus. Auch eine erhöhte Infektanfälligkeit kann durch einen Mangel an dem Immun-Vitamin verursacht werden. Besteht ein Mangel dauerhaft, kommt es zu Skorbut. Dieses Krankheitsbild ist unter anderem durch Zahnfleischblutungen, -entzündungen und Zahnverlust gekennzeichnet.
Dosierung und Einnahmeempfehlung für Vitamin C

Begleitend zur Einnahme von Säureblockern sind täglich zwischen 100 und 200 Milligramm Vitamin C sinnvoll. Bei einer bereits bestehenden Erkrankung, Immunschwäche oder einem handfesten Vitamin-C-Mangel empfehlen Mikronährstoff-Experten höhere Dosierungen wie 500 bis 1.000 Milligramm täglich.
Vitamin C kann zu den Mahlzeiten eingenommen werden, aber auch dazwischen. Die Einnahme zum Essen verbessert allerdings die Verträglichkeit für den Magen.
Vitamin C: zu beachten in der Schwangerschaft und Stillzeit, bei Erkrankungen und Medikamenteneinnahme
In der Schwangerschaft und Stillzeit werden bis zu 110 Milligramm Vitamin C empfohlen. Höhere Mengen sollte man mit dem Arzt absprechen. Wahrscheinlich ist Vitamin C aber bis maximal 1.800 Milligramm pro Tag sicher.
Da Vitamin C die Eisenaufnahme verbessert, sollten Menschen mit krankhafter Eisenüberladung (Hämochromatose) Vitamin C nur unter ärztlicher Aufsicht ergänzen.
Vitamin C sollte bei Nierenschwäche (Niereninsuffizienz) nicht über 500 Milligramm pro Tag dosiert werden. Kranke Nieren können damit nicht umgehen. Bei einer Neigung zu Nierensteinen sollten nicht mehr als 1.000 Milligramm Vitamin C pro Tag ergänzt werden.
Vitamin C könnte die Wirkung einer Chemotherapie herabsetzen, zum Beispiel die des Blutkrebs-Wirkstoffs Bortezomib (wie Velcade®) oder der Wirkstoffe Doxorubicin, Methotrexat sowie Cisplatin. Es sollte deshalb bei Krebs nur nach Absprache mit dem Arzt eingenommen werden.
Dosierungen auf einen Blick
Mikronährstoffempfehlung bei Säureblockern pro Tag | |
|---|---|
Vitamin B12 | 50 bis 250 Mikrogramm(µg) |
Vitamin C | 100 bis 1.000 Milligramm (mg) |
Calcium | 250 bis 1.000 Milligramm |
Magnesium | 100 bis 300 Milligramm |
Eisen | unter ärztlicher Kontrolle: leichter Mangel: 20 bis 40 Milligramm starker Mangel: 50 bis 100 Milligramm |
Sinnvolle Laboruntersuchungen auf einen Blick
Sinnvolle Blutuntersuchungen bei Säureblockern | |
|---|---|
| Optimalwerte |
Vitamin B12 | über 54 Pikomol pro Liter (pmol/l) (als Holotranscobalamin bestimmen) |
Homocystein | 5 bis 9 Mikromol pro Liter (µmol/l) |
Magnesium | 1,38 bis 1,50 Millimol pro Liter (mmol/l) |
Eisen | 34 bis 310 Mikrogramm Ferritin pro Liter (µg/l) bei Männern, 23 bis 110 Mikrogramm pro Liter bei Frauen |
Zusammenfassung
Säureblocker (Protonenpumpenhemmer) reduzieren die Freisetzung von Magensäure. Sie werden zur Behandlung von Sodbrennen, Magen- und Darmgeschwüren sowie bei der Therapie des Magenbakteriums Helicobacter pylori angewendet.
Die langfristige Einnahme von Säureblockern kann zu einem Mangel an verschiedenen Mikronährstoffen führen. Dazu gehören Vitamin B12 und C, Calcium, Magnesium sowie Eisen. Damit der Körper diese Stoffe aus der Nahrung aufnehmen kann, ist genügend Magensäure erforderlich. Bei Personen, die regelmäßig und über eine lange Zeit Säureblocker einnehmen, kann es sein, dass die Magensäure nicht ausreicht, um eine bedarfsgerechte Versorgung mit diesen Nährstoffen sicherzustellen.
Mikronährstoff-Experten empfehlen daher bei langfristiger Anwendung von Säureblockern ein Mikronährstoffpräparat mit den betroffenen Nährstoffen, um einen Mangel zu vermeiden. Der Versorgungsstatus von Vitamin B12, Eisen und Magnesium sollte regelmäßig überprüft werden. Blutmessungen des Homocysteins sind ebenfalls sinnvoll. Bei zu hohen Homocysteinwerten sollten B-Vitamine eingenommen werden.
Verzeichnis der Studien und Quellen
Ajmera, A.V. et al. (2012): Suboptimal response to ferrous sulfate in iron-deficient patients taking omeprazole. Am J Ther. 2012 May;19(3):185-9. https://pubmed.ncbi.nlm.nih.gov/21150767/, abgerufen am 03.05.2023.
Ali, M.D. (2023): Proton Pump Inhibitors' Use and Risk of Iron Deficiency Anaemia: A Systematic Review and Meta-analysis. Curr Rev Clin Exp Pharmacol. 2023;18(2):158-166. https://pubmed.ncbi.nlm.nih.gov/35255801/, abgerufen am 03.05.2023.
Aroda, V.R. et al. (2016): Long-term Metformin Use and Vitamin B12 Deficiency in the Diabetes Prevention Program Outcomes Study. J Clin Endocrinol Metab. 101(4):1754-61. https://www.ncbi.nlm.nih.gov/pubmed/26900641, abgerufen am: 24.07.2018.
Biesaklsi, H.K. (2016): Vitamine und Minerale. Indikation, Diagnostik, Therapie. 1. Aufl. Georg Thieme Verlag Stuttgart New York.
Cheungpasitporn, W. (2015): Proton pump inhibitors linked to hypomagnesemia: a systematic review and meta-analysis of observational studies. Ren Fail. 37(7):1237-41. https://www.ncbi.nlm.nih.gov/pubmed/26108134, abgerufen am: 24.07.2018.
Chinzon, D. et al. (2022): SAFETY OF LONG-TERM PROTON PUMP INHIBITORS: FACTS AND MYTHS. Arq Gastroenterol. 2022 Apr-Jun;59(2):219-225. https://pubmed.ncbi.nlm.nih.gov/35830032/, abgerufen am 03.05.2023.
Fischbach, W. et al. (2016): Helicobacter pylori und gastroduodenale Ulkuskrankheit. Z Gastroenterol. 2016; 54: 327–363. http://dx.doi.org/ 10.1055/s-0042-102967, abgerufen am: 24.07.2018.
Food and Drug Administration (FDA) (2010): FDA Drug Safety Communication: Possible increased risk of fractures of the hip, wrist, and spine with the use of proton pump inhibitors. Silver Spring, MD: US Food and Drug Administration. Available at: http://www.fda.gov/Drugs/DrugSafety/postmarketdrugsafetyInformationforpatientsandproviders/ucm213206.htm#TableofEpidemiologicalStudiesevaluatingfractureriskwithprotonpumpinhibitors, abgerufen am: 24.07.2018.
Gommers, L.M.M. et al. (2022): Mechanisms of proton pump inhibitor-induced hypomagnesemia. Acta Physiol (Oxf). 2022 Aug;235(4):e13846. https://pubmed.ncbi.nlm.nih.gov/35652564/, abgerufen am 03.05.2023.
Gröber, U. & Kisters, K. (2022): Arzneimittel als Mikronährstoff-Räuber – Was Ihnen Ihr Arzt nicht gesagt hat. 3. aktualisierte Auflage, Wissenschaftliche Verlagsgesellschaft, Stuttgart, 2022.
Gröber, U. (2015): Interaktionen, Arzneimittel und Mikronährstoffe. 2. Aufl. Wissenschaftliche Verlagsgesellschaft Stuttgart.
Gröber, U. (2018): Arzneimittel und Mikronährstoffe – Medikationsorientierte Supplementierung. 4. Aufl. Wissenschaftliche Verlagsgesellschaft Stuttgart.
Gröber, U. (2020): Protonenpumpenhemmer (PPI): Mikronährstoff-Räuber mit nachhaltigen Nebenwirkungen. Zeitschrift für Orthomolekulare Medizin 2022; 20(01): 14-21. https://www.thieme-connect.com/products/ejournals/abstract/10.1055/a-1743-6980, abgerufen am: 13.10.2022.
Gröber, U. et al. (2018): Important drug-micronutrient interactions: a selection for clinical practice. Crit Rev Food Sci Nutr. 2018 Dec 23:1-19. https://www.ncbi.nlm.nih.gov/pubmed/30580552, abgerufen am: 14.01.2019.
Gröber, U. et al. (2020): Important drug-micronutrient interactions: A selection for clinical practice. Crit Rev Food Sci Nutr. 2020;60(2):257-275. https://pubmed.ncbi.nlm.nih.gov/30580552/, abgerufen am: 13.10.2022.
Heidelbaugh, J.J. (2013): Proton pump inhibitors and risk of vitamin and mineral deficiency: evidence and clinical implications. Therapeutic Advances in Drug Safety. 4(3):125–133. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4110863/, abgerufen am: 24.07.2018.
Henry, E.B. (2005): Proton pump inhibitors reduce the bioavailability of dietary vitamin C. Aliment Pharmacol Ther. 22(6):539-545. onlinelibrary.wiley.com/doi/pdf/10.1111/j.1365-2036.2005.02568.x, abgerufen am: 24.07.2018.
Hess, M.W. et al. (2012): Systematic review: hypomagnesaemia induced by proton pump inhibition. Aliment Pharmacol Ther. 36(5):405-413. http://www.ncbi.nlm.nih.gov/pubmed/22762246, abgerufen am: 24.07.2018.
Huang, X. et al. (2010): Iron deficiency anaemia can be improved after eradication of Helicobacter pylori. Postgrad Med J. 2010 May;86(1015):272-8. https://pubmed.ncbi.nlm.nih.gov/20448223/, abgerufen am 03.05.2023.
Hussain, S. et al. (2018): Proton pump inhibitors' use and risk of hip fracture: a systematic review and meta-analysis. Rheumatol Int. 2018 Nov;38(11):1999-2014. https://pubmed.ncbi.nlm.nih.gov/30159775/, abgerufen am 03.05.2023.
Ito, T. & Jensen, R.T. (2010): Association of Long-term Proton Pump Inhibitor Therapy with Bone Fractures and effects on Absorption of Calcium, Vitamin B12, Iron, and Magnesium. Current Gastroenterology Reports. 12(6):448–457.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2974811/, abgerufen am: 24.07.2018.
Jensen, R.T. (2006): Consequences of long-term proton pump blockade: Highlighting insights from studies of patients with gastrinomas. Basic Clin Pharmacol Toxicol. 98:4–19. https://www.ncbi.nlm.nih.gov/pubmed/16433886, abgerufen am: 24.07.2018.
Khalili, H. et al. (2012): Use of proton pump inhibitors and Use of proton pump inhibitors and risk of hip factors: a prospective cohort study. Brit Med J. 344:e372. https://www.ncbi.nlm.nih.gov/pubmed/22294756, abgerufen am: 24.07.2018.
Koop, H. (1992): Review article: metabolic consequences of long-term inhibition of acid secretion by omeprazole. Aliment Pharmacol Ther. 6:399-406. https://www.ncbi.nlm.nih.gov/pubmed/1420733, abgerufen am: 24.07.2018.
Koop, H. et al. (1992): Serum iron, ferritin, and vitamin B12 during prolonged omeprazole therapy. J Clin Gastroenterol. 14:288–292. https://www.ncbi.nlm.nih.gov/pubmed/1607604, abgerufen am: 24.07.2018.
Lam, J.R. (2017): Proton Pump Inhibitor and Histamine-2 Receptor Antagonist Use and Iron Deficiency. Gastroenterology. 152(4):821-829. https://www.ncbi.nlm.nih.gov/pubmed/27890768, abgerufen am: 24.07.2018.
Lam, J.R. et al. (2013): Proton Pump Inhibitor and Histamine 2 Receptor Antagonist Use and Vitamin B12 Deficiency. JAMA. 2013;310(22):2435–2442. jamanetwork.com/journals/jama/fullarticle/1788456, abgerufen am: 24.07.2018.
Liu, J. et al. (2019): Proton pump inhibitors therapy and risk of bone diseases: An update meta-analysis. Life Sci. 2019 Feb 1;218:213-23. https://pubmed.ncbi.nlm.nih.gov/30605646/, abgerufen am 03.05.2023.
Maes, M.L. et al. (2017): Adverse effects of proton-pump inhibitor use in older adults: a review of the evidence. Therapeutic Advances in Drug Safety. 8(9):273–297. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5557164/, abgerufen am: 24.07.2018.
McColl, K. (2009) Effect of proton pump inhibitors on vitamins and iron. Am J Gastroenterol. 104(2): 5–9. https://www.ncbi.nlm.nih.gov/pubmed/19262546, abgerufen am: 24.07.2018.
Michalek, W. et al. (2011): Impact of acid suppression on upper gastrointestinal pH and motility. Dig Dis Sci. 56(6):1735-42. https://www.ncbi.nlm.nih.gov/pubmed/21086166, abgerufen am: 24.07.2018.
Miret, S. (2003): Physiology and molecular biology of dietary iron absorption. Annu Rev Nutr. 23:283–301. https://www.ncbi.nlm.nih.gov/pubmed/12626689, abgerufen am: 24.07.2018.
Mizunashi, K. et al. (1993): Effect of omeprazole, an inhibitor of H+K(+)-ATPase, on bone resorption in humans. Calcif Tissue Int. 53(1):21-5. https://www.ncbi.nlm.nih.gov/pubmed/8102318, abgerufen am: 24.07.2018.
Mowat, C. et al. (1999): Omeprazole and dietary nitrite independently affect levels of vitamin C and nitrite in gastric juice. Gastroenterology. 116: 813–822. https://www.ncbi.nlm.nih.gov/pubmed/10092303, abgerufen am: 24.07.2018.
Mumtaz, H. et al. (2022): Association of Vitamin B12 deficiency with long-term PPIs use: A cohort study. Ann Med Surg (Lond). 2022 Sep 26;82:104762. https://pubmed.ncbi.nlm.nih.gov/36268318/, abgerufen am 03.05.2023.
Ngamruengphong, S. et al. (2011): Proton pump inhibitors and risk of fracture analysis of observational studies. Am J Gastroenterol. 106: 1209-1218, https://www.ncbi.nlm.nih.gov/pubmed/21483462, abgerufen am: 24.07.2018.
O'Connell, M.B. et al. (2005): Effects of proton pump inhibitors on calcium carbonate absorption in women: a randomized crossover trial. Am J Med. 118(7):778-81. https://www.ncbi.nlm.nih.gov/pubmed/15989913, abgerufen am: 24.07.2018.
Park, C.H. et al. (2014): The Association between the Use of Proton Pump Inhibitors and the Risk of Hypomagnesemia: A Systematic Review and Meta-Analysis. PLoS ONE. 9(11):e112558. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4230950/, abgerufen am: 24.07.2018.
Park, D.H. et al. (2022): Long-term proton pump inhibitor use and risk of osteoporosis and hip fractures: A nationwide population-based and multicenter cohort study using a common data model. J Gastroenterol Hepatol. 2022 Aug;37(8):1534-43. https://pubmed.ncbi.nlm.nih.gov/35501296/, abgerufen am 03.05.2023.
Perazella, M.A. (2013): Proton pump inhibitors and hypomagnesemia: a rare but serious complication. Kidney International. 2013 April;83(4);553-6. https://www.kidney-international.org/article/S0085-2538(15)55801-8/fulltext, abgerufen am 03.05.2023.
Poly, T.N. et al. (2018): Proton pump inhibitors and risk of hip fracture: a meta-analysis of observational studies. Osteoporos Int. 2019 Jan;30(1):103-14. https://pubmed.ncbi.nlm.nih.gov/30539272/, abgerufen am 03.05.2023.
Presse, N. et al. (2016): Vitamin B12 Deficiency Induced by the Use of Gastric Acid Inhibitors: Calcium Supplements as a Potential Effect Modifier. J Nutr Health Aging. 20(5):569-73, https://www.ncbi.nlm.nih.gov/pubmed/27102797, abgerufen am: 24.07.2018.
Qorraj-Bytyqi, H. et al. (2018): Proton Pump Inhibitors Intake and Iron and Vitamin B12 Status: A Prospective Comparative Study with a Follow up of 12 Months. Open Access Maced J Med Sci. 6(3):442-446. https://www.ncbi.nlm.nih.gov/pubmed/29610598, abgerufen am: 24.07.2018.
Recker, R.R. (1985): Calcium absorption and achlorhydria. New England Journal of Medicine. 313:70–3. https://www.ncbi.nlm.nih.gov/pubmed/4000241, abgerufen am: 24.07.2018.
Sapmaz, F. et al. (2016): The impact of Helicobacter pylori eradication on serum hepcidin-25 level and iron parameters in patients with iron deficiency anemia. Wien Klin Wochenschr. 2016 May;128(9-10):335-40. https://pubmed.ncbi.nlm.nih.gov/26932797/, abgerufen am 03.05.2023.
Sharma, V.R. (2004): Effect of omeprazole on oral iron replacement in patients with iron deficiency anemia. South Med J.97:887–889. https://www.ncbi.nlm.nih.gov/pubmed/15455980, abgerufen am: 24.07.2018.
Simonov, M. et al. (2020): Use of Proton Pump Inhibitors Increases Risk of Incident Kidney Stones. Clin Gastroenterol Hepatol. 2021 Jan;19(1):72-79.e21. https://pubmed.ncbi.nlm.nih.gov/32147588/, abgerufen am 03.05.2023.
Skikne, B.S. (1981): Role of gastric acid in food iron absorption. Gastroenterology. 81:1068–1071. https://www.ncbi.nlm.nih.gov/pubmed/7286584, abgerufen am: 24.07.2018.
Srinutta, T. et al. (2019): Proton pump inhibitors and hypomagnesemia: A meta-analysis of observational studies. Medicine (Baltimore). 2019 Nov;98(44):e17788. https://pubmed.ncbi.nlm.nih.gov/31689852/, abgerufen am 03.05.2023.
Stewart, C.A. et al. (1998): Assessment of the risk of iron malabsorption in patients with Zollinger-Ellison syndrome treated with long-term gastric acid antisecretory therapy. Aliment Pharmacol Ther. 12:83–98, https://www.ncbi.nlm.nih.gov/pubmed/9692706, abgerufen am: 24.07.2018.
Sui, W. et al. (2022): Proton pump inhibitors use and risk of incident nephrolithiasis. Urolithiasis. 2022 Aug;50(4):401-9. https://pubmed.ncbi.nlm.nih.gov/35499617/, abgerufen am 03.05.2023.
Suksridechacin, N. et al. (2020): Effect of prolonged omeprazole administration on segmental intestinal Mg2+ absorption in male Sprague-Dawley rats. World J Gastroenterol. 2020 Mar 21;26(11):1142-1155. https://pubmed.ncbi.nlm.nih.gov/32231419/, abgerufen am 03.05.2023.
Thongon, N. et al. (2016): Omeprazole suppressed plasma magnesium level and duodenal magnesium absorption in male Sprague-Dawley rats. Pflugers Arch. 2016 Nov;468(11-12):1809-1821. https://pubmed.ncbi.nlm.nih.gov/27866273/, abgerufen am 03.05.2023.
Toh, J.W. et al. (2015): Hypomagnesaemia associated with long-term use of proton pump inhibitors, Gastroenterology Report. 3(3):243–253. https://www.ncbi.nlm.nih.gov/pubmed/25138239, abgerufen am: 24.07.2018.
Uyar, S. (2018): Short-Term Effect of High-Dose Pantoprazol on Serum and Urinary Magnesium Levels. Clin Lab. 1;64(3):263-268. https://www.ncbi.nlm.nih.gov/pubmed/29739099, abgerufen am: 24.07.2018.
Van der Velde, R.Y. et al. (2014): Calcium and vitamin D supplementation: state of the art for daily practice. Food & Nutrition Research. 58, 10.3402/fnr.v58.21796. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4126954/, abgerufen am: 24.07.2018.
Wong, C.W. (2015): Vitamin B12 deficiency in the elderly: is it worth screening? Hong Kong Med J. 21(2):155-64. https://www.ncbi.nlm.nih.gov/pubmed/25756278, abgerufen am: 24.07.2018.
Yang, Y.X. (2008): Proton pump inhibitor therapy and osteoporosis. Curr Drug Saf. 3(3):204-9. https://www.ncbi.nlm.nih.gov/pubmed/18691003/, abgerufen am: 24.07.2018.
Yang, Y.X. (2012): Chronic PPI Therapy and Calcium Metabolism. Current Gastroenterology Reports, 14(6), 473–479. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4525469/, abgerufen am: 24.07.2018.
Yuan, W. et al. (2010): Iron deficiency anemia in Helicobacter pylori infection: meta-analysis of randomized controlled trials. Scand J Gastroenterol. 2010 Jun;45(6):665-76. https://pubmed.ncbi.nlm.nih.gov/20201716/, abgerufen am 03.05.2023.